寡核苷酸化学合成是什么?关于寡核苷酸化学合成的科普介绍

寡核苷酸化学合成(Oligonucleotide synthesis)是指用化学方法合成较短片段(一般<200个碱基对)的DNA或RNA的技术,目前多通过自动固相合成仪逐个添加亚磷酰胺单元实现。该方法不仅可以合成指定序列的DNA/RNA,更可根据需要掺入自然界里不存在的、人工修饰的核酸,故而自问世以来,推动了核酸生物化学的快速发展。该方法亦被广泛用于合成核酸引物、核酸探针(如病毒快速检测)、核酸药物(如基因疗法)等不同领域的应用中。
背景和概述
在生物中,DNA和RNA的合成主要由DNA/RNA聚合酶实现,这一过程需要一个模板链,利用碱基互补配对原则逐次添加核苷三磷酸(nucleoside triphosphate, NTP)单元,并在DNA/RNA聚合酶的催化下形成磷酸二酯键。虽然在体外,可以通过模拟这一过程大批量获得DNA(如聚合酶链式反应)或RNA,但存在样品纯度较低、合成需要模板、难以任意设计序列或添加化学修饰的核苷酸等问题。针对这些问题,自20世纪50年代起,科学家开始探索不借助DNA/RNA聚合酶和模板、完全通过有机化学的手段合成短链DNA/RNA(即寡核苷酸),并于上世纪80年代后实现了自动化和商品化。如今,绝大部分寡核苷酸都是利用自动化的设备通过固相亚磷酰胺化学法来进行合成。其具体过程由4步循环组成,分别是:1) 去保护;2) 偶联;3) 加帽和4) 氧化,且一个循环生成一个新的核苷酸。
亚磷酰胺单元
由于没有酶的催化,寡核苷酸化学合成的主要挑战是活化3'-OH(或5'-OH),使下一个核酸单元能够在较为温和的条件下逐次添加到寡核苷酸链上。历史上,科学家尝试过使用许多不同的活化基团,经过不断的优化,在20世纪80年代初开发出以亚磷酰胺(phosphoramidite)作为3'-OH活化基团的合成法,并成功实现了固相合成和自动化合成。
DNA合成的亚磷酰胺单元主要由碱基、脱氧核糖、5'-DMT(4,4'-二甲氧基三苯甲基)和3'端的2-氰乙基-N,N,N′,N′-四异丙基亚磷酰二胺(2-cyanoethyl N,N,N',N'-tetraisopropylphosphorodiamidite)组成,而RNA的亚磷酰胺单元中则需要对2'-OH进行额外的保护,以防止在固相合成中2'-OH与5'-OH或3'-OH交叉反应,该保护基团一般为叔丁基二甲基硅基(TBDMS)。此外,由于腺嘌呤、胞嘧啶和鸟嘌呤和一些人工碱基存在环外伯氨基,因此也需要在单元中用适当的保护基团对其保护。
固相载体
目前通用的商品化自动合成多为固相合成法,而固相合成是将核酸固定在固相载体上完成合成反应的,最常用的固相载体为可控微孔玻璃珠(CPG,controlled pore glass),CPG的孔径根据所合成的寡核苷酸的长度而定,一般合成链长小于60mer时,选择孔径500埃CPG;链长大于60mer时,使用1000埃CPG。使用 CPG 的偶联效率高达98%-99.9%,可以满足合成长达175mer的寡核苷酸的条件。CPG通过连接化合物(linker)与初始核苷酸的羟基共价结合,核苷酸的5'-OH用DMT保护。
合成循环
如前所述,寡核苷酸的自动化固相合成每个循环主要包括四个步骤:去保护、偶联、加帽和氧化,其示意图如下。


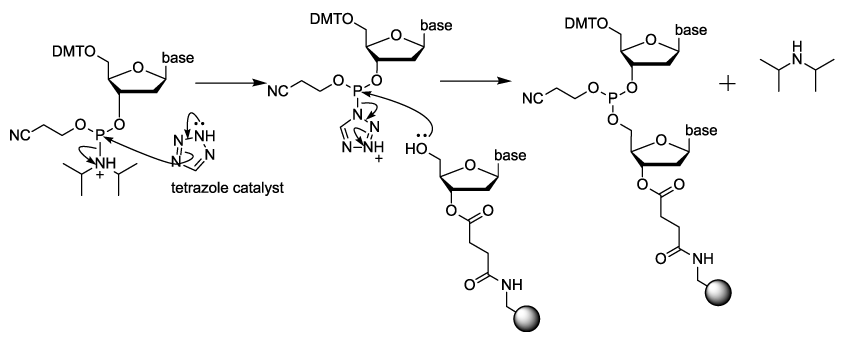


4) 氧化:偶联反应后新加上的核苷酸通过亚磷酯键(磷为三价)与CPG上的寡核苷酸链相连,此亚磷酯键不稳定,易被酸、碱水解,因此需将此处三价磷氧化为五价的磷。被氧化后形成的磷酸二酯键实际上就是DNA/RNA链中的磷酸二酯键外加一个2-氰乙基保护,该保护基可以使磷酸二酯键在后续的合成中更稳定。这一步常用的氧化剂为碘的四氢呋喃溶液,此步反应速度亦很快。这一步结束后,延伸后的寡核苷酸链进入下一循环,然后不断重复循环直至链延伸至所需长度。

合成后处理和纯化
寡核苷酸链延伸至所需长度后,尚需一系列后处理和纯化方能获得寡核苷酸成品以供直接使用或长期保存。
首先是将合成好的寡核苷酸链从支持物上化学切割下来。这一步常用新鲜的浓氨水来裂解CPG上连接化合物与初始核苷间的酯键,断裂下来的寡核苷酸末端带有自由的3'-OH。然后,溶解在浓氨水中的寡核苷酸链通过延长时间处理或略微加热,脱去磷酸二酯键上的2-氰乙基保护和碱基上的保护基团。RNA则需额外使用TBAF或TEA·3HF对2'-OH上的TBDMS脱保护。

未来的发展方向
虽然以固相亚磷酰胺法为基础的寡核苷酸化学合成在过去的几十年中取得了商品化的巨大成功,但这一技术在解决一些未来的合成生物学挑战时仍暴露出许多问题。例如,即便每一循环产率达到99%,要合成200nt的寡核苷酸,理论产率也只有13%,这还不考虑分离纯化时的损失。在合成较长核酸链时较低的产率也意味着更高的成本,这也大大限制了诸如基因合成、RNA干扰杀虫剂等技术的发展。此外,该方法还存在使用有毒有害试剂和溶剂的问题。因此,亟需开发成本更低、效率更高、更环保的核酸人工合成法。
无模板酶催化寡核苷酸合成(TiOES)
生物中的DNA/RNA聚合酶在温和的环境下即可合成长达数千个碱基长度的核酸链,但绝大多数都需要现成的模板。然而,存在这样一种酶,可以在无模板的条件下不断向DNA链末端添加新的核苷酸,最长可长达约8000个碱基长度,这种酶叫做末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase,TdT)。近年来,科学家尝试利用这种酶的特性,模仿固相化学合成的循环,在温和条件下实现超长DNA链的从头合成:

本文转载于:搜狗科学,baike.sogou.com/kexue/d54248274311307782.htm,本内容使用CC-BY-SA 3.0授权,用户转载请注明出处