蛋白降解靶向嵌合体是什么?

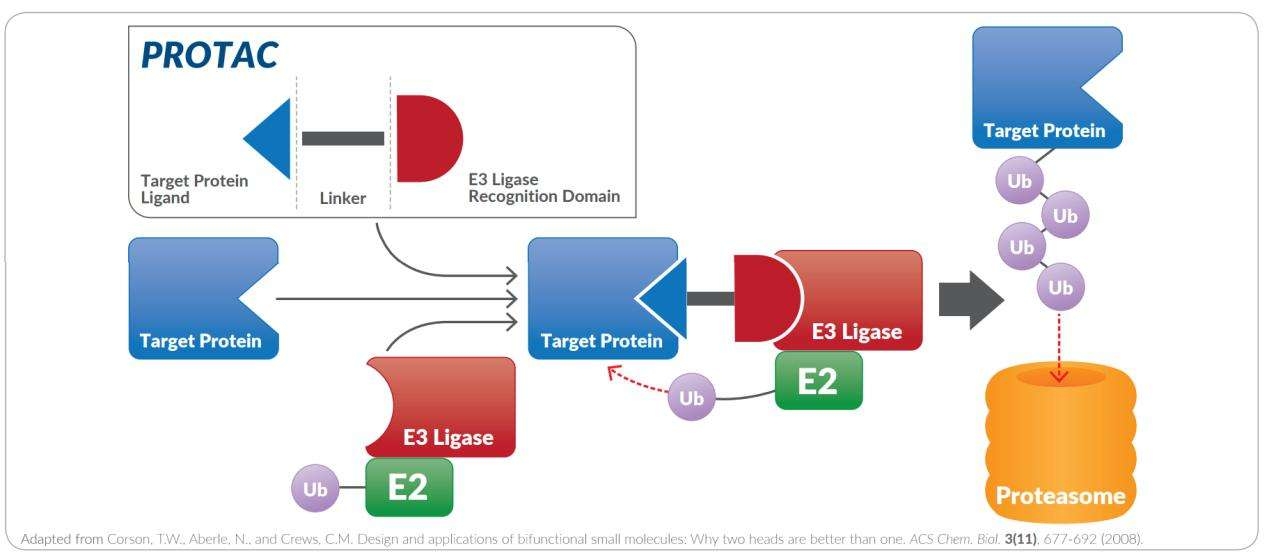
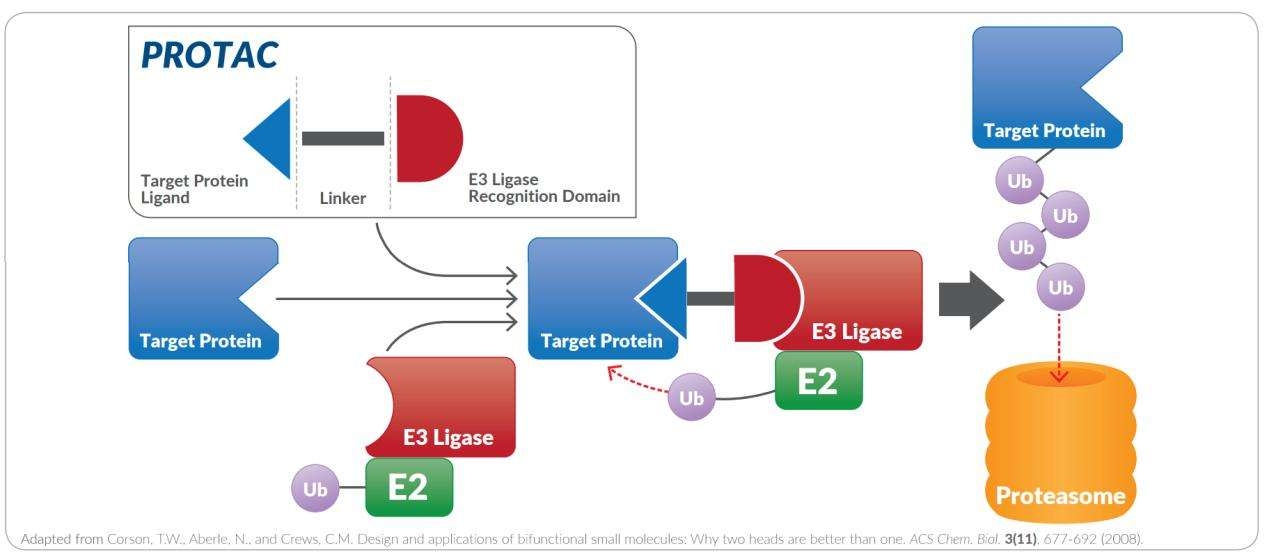
蛋白降解靶向嵌合体(英文:proteolysis targeting chimera 缩写:PROTAC)是一种异双功能小分子,由三部分组成:热门靶向蛋白高度亲和力小分子,E3连接酶高度亲和力的小分子以及连接两者的链接子。E3连接酶与靶蛋白的结合导致蛋白酶体的泛素化和靶蛋白的后续降解。
1、概论
与直接抑制蛋白质活性的传统药物相比,PROTAC通过利用蛋白酶体介导的蛋白水解作用,使我们体内的蛋白质降解系统参与到消灭靶向蛋白的过程中来,以选择性降解致病蛋白,从而治疗癌症或其他难以治疗的疾病。PROTAC是一种双功能小分子,由一个连接子和两个弹头组成-一个与靶蛋白结合,另一个吸收E3连接酶(见图1)。通过这种双功能特性,致病蛋白可以被蛋白酶体泛素化和降解,从而身体恢复正常。作为一种新颖的药物设计思路,它有可能提供超越现有方法的治疗措施。因为PROTAC只需要以高选择性结合其靶标即可(而不是抑制靶蛋白的酶促活性),因此目前有许多已验证过活性和安全性的小分子抑制剂改造为下一代PROTAC降解剂。
2、PROTAC特点
PROTAC优势
-
克服肿瘤耐药性
-
延长作用时间
-
降解致病蛋白而不是抑制它们
-
低剂量
-
减少毒性
PROTAC挑战
-
E3连接酶与靶蛋白的配对组合仍基于传统经验,效率低,不利于E3连接酶配体的开发和利用。
-
配体小分子不易寻找
-
降解水平的不确定性
-
耐药性的产生和克服方法
PROTAC和其他类型药物特点比较
| 药物特性 | 小分子 | 单抗 | siRNA | PROTAC |
| 不需要活性位点 | 需要 | 需要 | 不需要 | 不需要 |
| 彻底消灭蛋白 | 不能 | 不行 | 行 | 行 |
| 靶向支架蛋白 | 不能 | 能 | 行 | 行 |
| 开发难易度 | 难 | 易 | 易 | 易 |
| 组织穿透性 | 能 | 能 | 不能 | 行 |
| 系统给药 | 可行 | 可行 | 不行 | 行 |
| 给药途径 | PO/IV/SC | IV/SC | IV/SC | PO/IV/SC |
3、发展历程
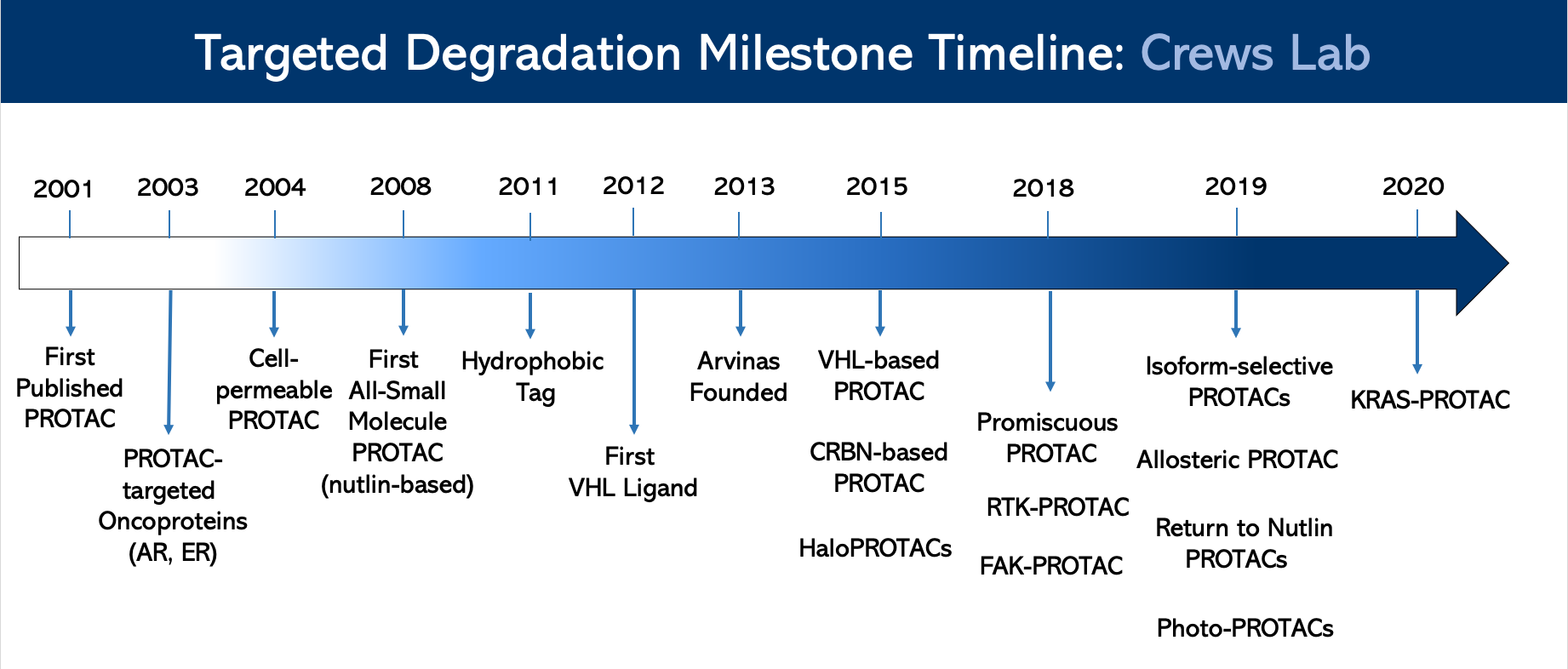
令人对此项技术看好的是,该公司开发的全球首个PROTAC药物ARV-110,拟用于治疗去势抵抗性前列腺癌,已经进入临床I期研究阶段,临床I期的初始数据表明ARV-110具有良好的口服利用度和良好的安全性和耐受性。
到目前为止,蛋白降解剂的研究主要集中在肿瘤领域,并在神经退行性疾病、炎症/免疫学领域有所发现。
4、PROTAC 设计与合成
目标蛋白的配体设计
用泛素化标记靶蛋白是被PROTAC分子降解之前的关键事件。配体设计可以参考现有的相关把蛋白小分子抑制剂。
E3连接酶的配体筛选
可以募集E3连接酶来标记目标蛋白,以通过蛋白酶体进行泛素化和降解。
链接子设计和优化
如图所示,PROTAC接头连接两个头:用于E3泛素连接酶识别的小肽或分子,以及用于靶蛋白识别的配体。使用多种类型的链接子可以优化PROTAC的长度和位置,以使靶蛋白和E3连接酶之间达到最大相互作用,从而实现靶蛋白的有效泛素化及其最终降解。
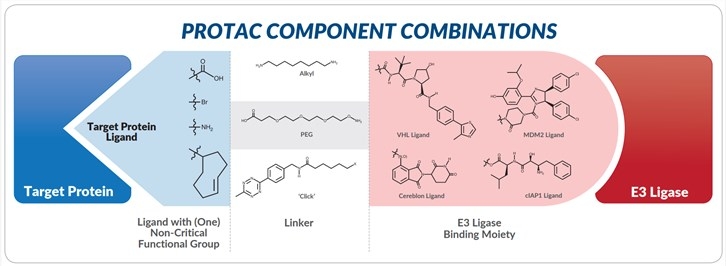
PROTAC结构修改
PROTAC分子的细胞渗透性和降解选择性程度可以通过可变接头E3连接酶部分组合与特定目标蛋白配体的结构修饰或“混合和匹配”来优化。
PROTAC工作流程图
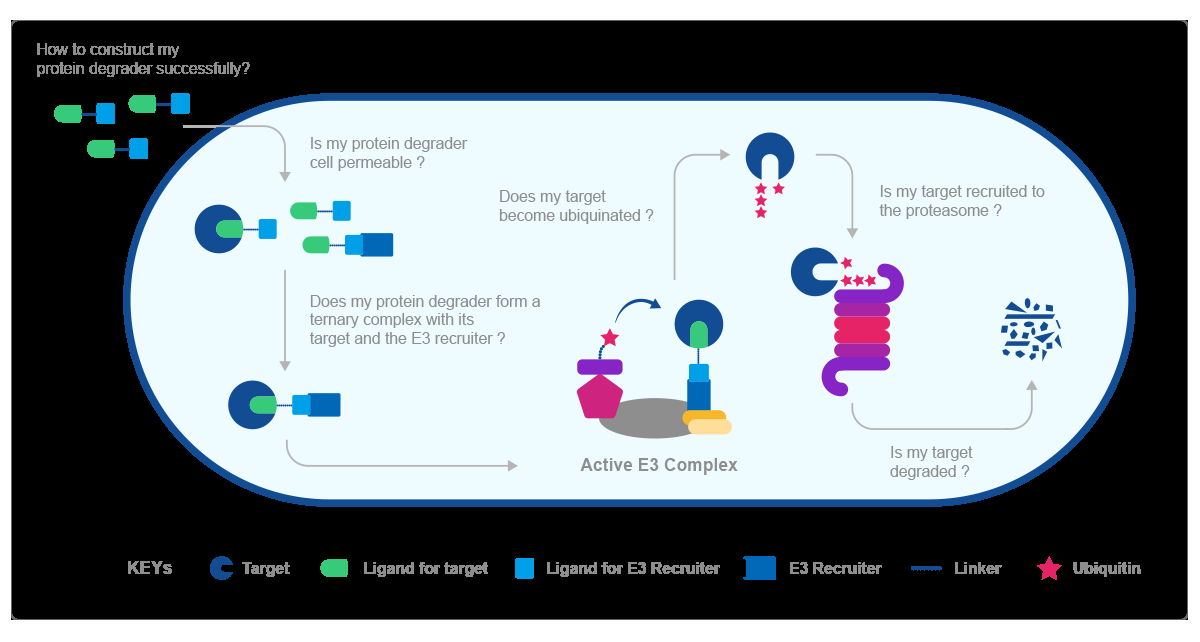
第一步:如何成功构建PROTAC分子
第二步:PROTAC分子能否成功穿透并进入细胞;
第三步:一旦进入细胞,靶蛋白-PROTAC分子- E3连接酶的三元复合物能否形成;
第四步:能否形成活化的E3复合体;
第五步:靶蛋白能否被泛素化;
第六步:泛素化的靶蛋白能否被蛋白酶体识别并结合;
第七步:靶蛋白是否发生降解。
本文转载于:搜狗科学,baike.sogou.com/kexue/d78751394722558220.htm,本内容使用CC-BY-SA 3.0授权,用户转载请注明出处