纺锤体是什么?关于纺锤体的科普介绍

纺锤体是真核细胞有丝分裂或减数分裂过程中形成的中间宽两端窄的纺锤状细胞结构,主要由大量纵向排列的微管构成。纺锤体一般产生于早前期,并在分裂末期消失。纺锤体主要元件包括极间丝、着丝点丝、星体丝及区间丝四种微管和附着在微管上的动力分子分子马达以及一系列复杂的超分子结构组成。
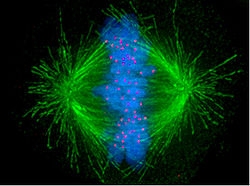
纺锤体结构
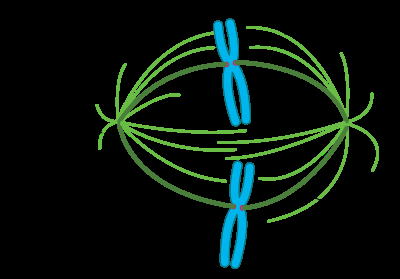
微管与染色体的连接是由动粒介导的。动粒能主动监测纺锤体的形成并防止过早的进入细胞分裂后期。微管聚合和解聚的动态变化驱动染色体聚集。微管解聚时会在动粒上产生张力; 姐妹动粒与相反细胞两极所产生微管的双极连接伴生了相反的张力,使染色体在细胞赤道对齐,并使它们与子细胞分离。一旦每条染色体都变成双向的,细胞分裂进入后期,连接姐妹染色单体的黏连蛋白(cohesin)被切断,允许姐妹染色单体移动到相反的两极。
细胞纺锤体包括纺锤体微管、相关蛋白(包括驱动蛋白和动力蛋白分子马达)、凝聚的染色体和根据细胞类型可能存在于纺锤极的中心体或星状体。 纺锤体的横截面是模糊的椭球体,端部呈锥形。在被称为纺锤体中间带的中间较宽部分,反向平行的微管被驱动蛋白捆绑在一起。在称为纺锤极的尖端,微管在大多数动物细胞中被中心体凝聚成核。无中心体或无星状体纺锤体顾名思义,是指分别在纺锤极体缺少中心体或星状体,它们会出现在例如大多数雌性动物的减数分裂期间。 在这种情况下,Ran GTP浓度梯度是纺锤体微管组织和组装的主要调节因素。在真菌中,纺锤体形成于嵌入核膜的纺锤极体之间,在有丝分裂期间不会崩解。
微管相关蛋白与纺锤体动力学
纺锤体微管的动态延长和缩短,通过动态不稳定性的过程,在很大程度上决定有丝分裂纺锤体的形状,并促进纺锤体中段染色体的正确排列。微管结合蛋白(MAPs)在中间区和纺锤体极与微管结合,以调节它们的动态变化。γ-微管蛋白是一种特殊的微管蛋白变体,它组装成γ-TuRC的环状复合物,该复合物可以将α/β微管蛋白异二聚体聚合成微管。γ-TuRC被募集到中心体周围区域来稳定微管负端,并将它们锚定在微管组织中心附近。微管相关蛋白Augmin与γ-TURC共同作用,使新微管从现有微管分离而成核。
微管正端跟踪蛋白(+TIPs)可以保护微管的生长末端免受崩解,以促进微管与中间区的动粒结合。在海拉(HeLa) 细胞中CLIP170被认为定位于微管正端附近, 并于细胞分裂前期在动粒中积累。 尽管还不清楚CLIP170是如何识别正端,但已经表明它的同源物可以防止微管崩解并促进其生长, 这表明CLIP170在稳定正端和可能介导它们与动粒的直接连接方面发挥了作用。CLIP相关蛋白,如人类的CLASP1,也被证明定位于正端和外动粒,并调节动粒微管的动态变化。果蝇、爪蟾和酵母中的CLASP同源物是纺锤体正确组装所必需的;在哺乳动物中,CLASP1和CLASP2都有助于后期纺锤体的正确组装和微管动态变化。 EB1蛋白可以进一步调节正端微管聚合,EB1蛋白直接结合微管的生长端,并协调其他+TIPs的结合。
与这些微管稳定蛋白的作用相反的是数量众多的微管解聚因子,微管解聚因子允许有丝分裂纺锤体的动态重塑,以促进染色体聚集和实现双极化。MAPs的驱动蛋白-13超家族包含一类具有相关微管解聚活性的正端导向马达蛋白,包括被深入研究的哺乳动物MCAK和爪蟾XKCM1。MCAK定位于动粒微管生长的尖端,在那里它可以通过破坏+TIP活性而引发微管崩解。 这些蛋白质利用ATP水解的能量诱导原丝结构的不稳定构象变化,从而导致驱动蛋白释放和微管解聚。 它们活性的丧失导致许多有丝分裂缺陷。其他微管不稳定蛋白包括Op18/stathmin和katanin,它们在有丝分裂纺锤体重塑和细胞分裂后期染色体分离中起作用。
这些MAPs的活性受到细致的调节,以在纺锤体组装过程中维持适当的微管动态,其中许多蛋白质是Aurora和Polo-like激酶底物。
组织纺锤体
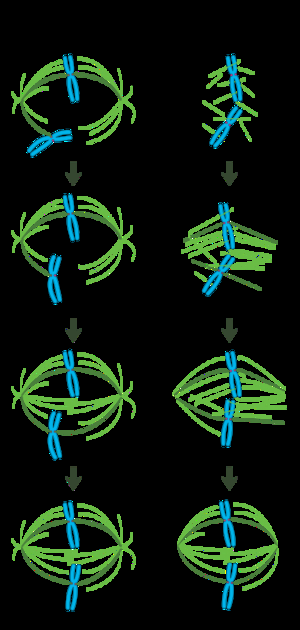
在一个正确形成的有丝分裂纺锤体中,双向染色体沿着细胞赤道面上排列,纺锤体微管大致垂直于染色体,它们的正端嵌入在微粒中,而负端锚定在细胞两极。为了确保准确的染色体分离和确定细胞分裂平面,这种复合体的精确定位是必需的。然而,尚不清楚纺锤体是如何组织的。两种可能的模型在领域内处于主流地位,不过它们是相互补充的,而不是相互排斥的。在搜索-捕捉模型中,纺锤体主要由中心体微管组织中心的极向分离来组织。纺锤体微管从中心体发出,并“寻找”动粒;当它们与动粒结合时,它们变得稳定并对染色体施加张力。在另一种自组装模型中,微管在压缩的染色体中进行无中心体成核。受细胞尺寸、运动蛋白与反平行微管的横向连接以及与动粒末端连接的限制,微管自主采用纺锤体状结构,染色体沿细胞赤道排列。
中心体介导的“搜索和捕获”模型
在这个模型中,微管在微管组织中心成核,并经历快速生长和崩解,在细胞质中“寻找”动粒。一旦与动粒结合,它们就稳定下来,其动态变化程度也会减弱。新的单极染色体在它所附着的极体附近的空间振荡,直到来自相反极体的微管结合这个姐妹动粒。这第二次结合进一步使动粒在有丝分裂纺锤体上稳定附着。逐渐地,双向染色体被拉向细胞中心,直到微管张力在着丝粒两侧平衡;集合的染色体然后在中期板振荡,直到细胞分裂后期启动释放了姐妹染色单体的凝聚体。
在该模型中,微管组织中心定位于细胞极,它们的分离由微管聚合驱动,而纺锤体中间区反向平行纺锤体微管相对于彼此的“滑动”是由双极和正端定向驱动蛋白所介导的。 这种滑动力不仅可以解释有丝分裂早期的纺锤体极分离,还可以解释有丝分裂后期的纺锤体伸长。
染色质介导的有丝分裂纺锤体的自组织
与中心体在很大程度上决定有丝分裂纺锤体组织的搜索和捕获机制相反,该模型提出微管在染色体附近可以无中心粒成核并自发组装成反向平行束并采用纺锤体样结构。 希尔德(Heald)和卡森蒂(karsenti)的经典实验表明,在非洲爪蟾卵提取物中孵育的带有DNA的小珠周围可以形成有功能的有丝分裂纺锤体和细胞核,微管的双极排列在没有中心体和动粒的情况下也可以形成。 事实上,业已证明在脊椎动物细胞中,利用激光消融中心体,既不抑制纺锤体组装,也不抑制染色体分离。 在这个框架下,有丝分裂纺锤体的形状和大小是由交联马达蛋白的生物物理特性所决定的。
Ran GTP梯度法研究染色质介导的微管成核
小GTPase Ran(染色体凝聚调节因子1或RCC1)的鸟嘌呤核苷酸交换因子通过核心组蛋白H2A和H2B与核小体相连。 因此,在有丝分裂染色质附近产生了GTP结合的Ran的浓度梯度。在爪蟾卵提取物中,包裹着RCC1的玻璃珠会诱导微管成核和双极纺锤体形成,这表明单独Ran GTP梯度就足以进行纺锤体组装。 Ran GTP梯度通过转运蛋白importin β/α触发纺锤体组装因子(SAFs)从抑制性相互作用中释放。然后,未结合的SAFs促进有丝分裂染色质周围微管成核和稳定,纺锤体双极化由微管马达蛋白组织。
纺锤体组装的调节
纺锤体组装主要受有丝分裂激酶催化的磷酸化事件调节。细胞周期蛋白依赖激酶复合物(CDKs)由有丝分裂细胞周期蛋白激活,其翻译在有丝分裂期间增加。CDK1(也称为CDC2)被认为是哺乳动物细胞中主要的有丝分裂激酶,由细胞周期蛋白B1激活。Aurora激酶是纺锤体正确组装和分离所必需的。 Aurora A与中心体相关联,被认为调节有丝分裂的起始。Aurora B是染色体乘客复合体的一员,介导染色体-微管连接和姐妹染色单体凝聚。Polo-like激酶,又称PLK,尤其是PLK1,通过调节微管动态在纺锤体维持中具有重要作用。
有丝分裂染色体结构
在DNA复制结束时,姐妹染色单体结合在一起,形成一团杂乱的DNA和蛋白质混合物,几乎不可能平均分割进每个子细胞。为了避免这个问题,有丝分裂起始触发了已复制基因组的大规模重组。姐妹染色单体被解开并彼此分离。染色体长度也缩短了,在动物细胞中缩短了10,000倍, 这一过程称为染色体凝聚。染色体凝聚开始于有丝分裂前期,并在有丝分裂中期排列在纺锤体中间时被最大程度地压缩成棒状结构。这使有丝分裂染色体具有核型中典型“X”形,每个浓缩的姐妹染色单体通过凝聚蛋白沿其长度相连,并通常在着丝粒中心附近的连接。
虽然这些动态重排对于确保基因组的精确和高保真分离至关重要,但我们对有丝分裂染色体结构的理解仍然很不完整。不过,已经可以确定一小部分特定分子的功能: 拓扑异构酶II利用ATP水解来催化DNA纠缠的解除,促进姐妹染色单体的分解。 凝聚素是5-亚单位复合物,也利用三磷酸腺苷水解促进染色体凝聚。爪蟾卵提取物的实验也暗示了组蛋白H1作为连接者,是有丝分裂染色体紧密度的重要调节因子。
有丝分裂纺锤体检查点
纺锤体形成的完成是细胞周期中一个关键的转变点,称为纺锤体组装检查点。如果在这个检查点之前染色体没有正确地附着在有丝分裂纺锤体上,后期的开始将会延迟。 纺锤体组装检查点的故障会导致非整倍体,这可能与衰老和癌症的形成有关。
染色体定向
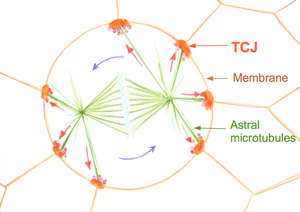
细胞分裂定向对组织结构、细胞命运和形态发生具有重要意义。细胞倾向于根据所谓的赫蒂威格(Hertwig)法则沿其长轴分裂。细胞分裂的轴由纺锤体的方向决定。细胞沿着连接纺锤体的两个中心体的线分裂。纺锤体形成后,它会在细胞内部经历旋转过程。起源于中心体的星形微管到达细胞膜,在那里它们被拉向特定的皮质线。 在体外,皮质线的分布是由粘附模式建立的。皮质线由位于细胞顶点的三细胞结点的定位决定。 皮质线的空间分布决定最终纺锤体方向和随后细胞分裂的方向。
本文转载于:搜狗科学,baike.sogou.com/kexue/d10063.htm,本内容使用CC-BY-SA 3.0授权,用户转载请注明出处