核定位信号是什么?关于核定位信号的科普介绍

核定位信号(Nuclear localization signal, NLS)也称核定位序列,是指一段短的氨基酸序列,可以用于引导蛋白质通过核孔复合体进入细胞核。将核定位信号标签与异源蛋白融合后可以引导非核定位的异源蛋白进入细胞核,而破坏一个蛋白的核定位信号则会抑制该蛋白进入细胞核。核定位信号通常包含一个或多个带正电的氨基酸(如赖氨酸、精氨酸等碱性氨基酸),这些氨基酸暴露在蛋白表面,在转运入核过程中与输入蛋白(importin)的带负电的氨基酸残基形成盐桥(salt bridge),引导蛋白入核。蛋白入核后,核定位信号也不会被切割,而具有出核信号(Nuclear export signal, NES)的蛋白可以被引导通过核孔复合体向细胞质运输,从而实现蛋白在胞质和核内之间的穿梭。
核定位信号的类型
目前核定位信号主要分为经典核定位信号(Classical NLS)和非经典核定位信号(Non-classical NLS)两种。经典核定位信号又可以分为单组分核定位信号(Monopartite-type NLS)和双组分核定位信号(Bipartite-type NLS)。
经典核定位信号
经典核定位信号分两种为单组分核定位信号(Monopartite-type NLS)和双组分核定位信号(Bipartite-type NLS)。他们的主要区别在于单组分核定位信号只有一簇带正电的氨基酸残基;而双组分核定位信号则包含两簇带正电的氨基酸残基,由一小段间隔序列从中间分隔开。例如,SV40大T抗原(Simian virus 40 large T-antigen)核定位信号是人类首次发现的核定位信号,它是典型的单组分核定位信号。而人类首次发现的分子伴侣-核质蛋白(nucleoplasmin)则具有典型的双组分核定位信号,它具有由10个氨基酸残基的间隔序列分隔开地两簇带正电的氨基酸。这两种核定位信号都可以被输入蛋白α(importin α)结合,而输入蛋白α自身也具有一个双组分核定位信号,可以被转运中介因子输入蛋白β(importin β)识别,从而将目标蛋白转运进细胞核。几种典型的核定位信号序列参见表1。
| 表1. 几种典型的单组分和双组分核定位信号 | |||
| 核定位信号来源 | 核定位信号的序列 | 发现人 | |
| 单组分核定位信号 | |||
| SV40(simian virus 40) | PKKKRKV | (Kalderon et al., 1984) | |
| H2B( Histone H2B) | GKKRSKV | (Moreland et al., 1987) | |
| v-Jun | KSRKRKL | (Chida and Vogt, 1992) | |
| c-Myc | PAAKRVKLD | (Dang and Lee, 1988) | |
| 共有序列 | KKxK | ||
| 双组分核定位信号 | |||
| Nucleoplasmin | KRPAATKKAGQAKKKKL | (Robbins et al., 1991) | |
| SV40 mutant | KRTADSQHSTPPKTKRKV | (Makkerh et al., 1996) | |
| 共有序列 | 2K/R-10~12 aa-3K/R | ||
非经典核定位信号
非经典核定位信号主要是指核定位信号不具有典型核定位信号的序列特征或为含有带负电的氨基酸残基。例如人不均一核核糖核蛋白A1(hnRNP A1)的核定位信号位于富含带负电的酸性氨基酸残基的M9结构域内,而酵母的转录抑制因子Matα2的核定位信号序列则为KIPIK。大多数此类核定位信号由输入蛋白β直接识别进行转运。核糖体蛋白的核定位信号则可能是由一种特异的输入蛋白β样转运受体所识别,因此也属于非经典核定位信号。部分核转运蛋白β参见表2。
| 表2. 几种已知的核转运蛋白β及其酵母同源基因 | |||
| Kap超家族 | 人源蛋白(别名) | 基因名(别名) | 酵母同源基因(别名) |
| IMB1 | Importin-β1 (Kapβ1) | KPNB1 (NTF97) | Kap95 |
| IMB2 | Transportin-1 (Kapβ2, Imp-β2) | TNPO1 (KPNB2, TRN) | Kap104 |
| Transportin-2 | TNPO2 | ||
| Transportin-2 Isoform 2 (Kapβ2b) | |||
| IMB3 | Importin-5 (Kapβ3, Imp-β3, RanBP5) | IPO5 (KPNB3, RANBP5) | Kap121 (Pse1) |
| IMB4 | Importin-4 (Imp-4b, RanBP4) | IPO4 (IMP4B, RANBP4) | Kap123 (YRB4) |
| IPO8 | Importin-7 (RanBP7) | IPO7 (RANBP7) | Kap119 (Nmd5) |
| Importin-8 (RanBP8) | IPO8 (RANBP8) | Kap108 (Sxm1) | |
| IMB5 | Importin-9 (RanBP9) | IPO9 (IMP9, RANBP9) | Kap114 (Imp-β5, Kap-β5) |
| KA120 | Importin-11 (RanBP11) | IPO11 (RANBP11) | Kap120 |
| TNP03 | Transportin-3 (Transportin-SR, Imp-12) | TNPO3 (IPO12) | Mtr10 (Kap111), Kap122 (Pdr6) |
| Transportin-SR2 (isoform 2 of Trn-SR) | - | - | |
| Importin-13 (Kap13, RanBP13) | IPO13 (RANBP13) | - | |
| XPO4 | Exportin-4 | XPO4 | - |
部分蛋白所具有地PY-NLSs的核定位信号具有脯氨酸-酪氨酸配对结构,可以由输入蛋白β2结合并转运。输入蛋白β由称为核转运蛋白β(Karyopherin β),直接参与蛋白核转运并且部分可以向核内或胞质双向运输。
核定位信号的发现过程
细胞的核膜作为一道天然的屏障将真核生物核内DNA的复制转录过程与核外的蛋白产物分隔开,而核外产生的蛋白则需要通过一定的过程进入细胞核内发挥功能。19世纪60年代,英国发育生物学家John Gurdon首次用实验来证明核蛋白具有在细胞核内富集的能力。他将纯化的细胞核蛋白它能够给显微注射的方式输入蛙卵细胞中并发现这些核蛋白会在蛙卵细胞核内富集。卵细胞核膜上成千上万的核孔复合物可以允许不同的分子进入细胞核中,说明这些核孔复合物是核蛋白自由进出细胞核的通道,而此时的科学家则认为这些蛋白通过这些通道进出细胞核是没有特异的转运机制的。
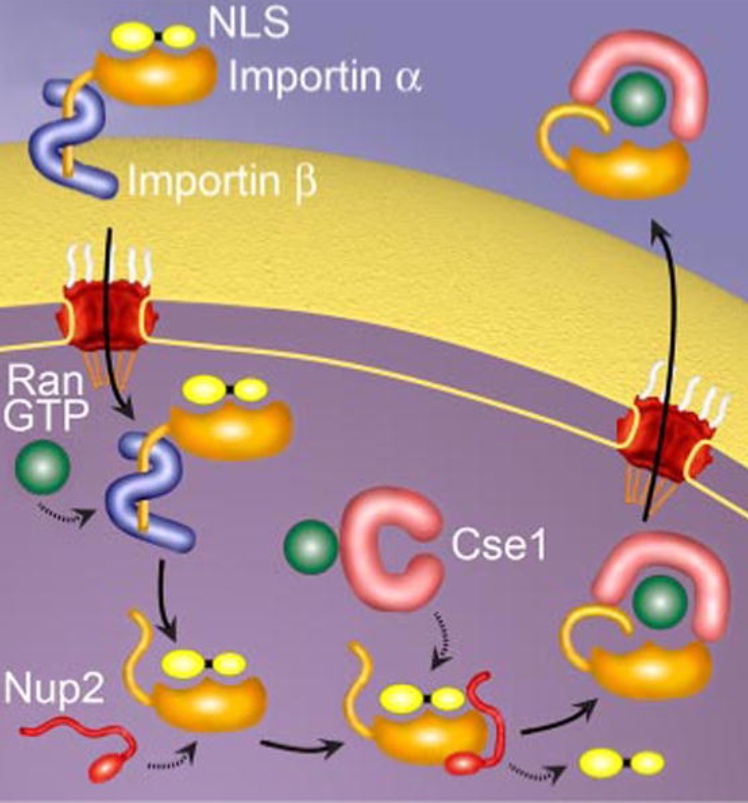
通过蛋白质结构解析,核蛋白越来越多的细节被人类发现。核蛋白通过两个步骤进入细胞核,即核蛋白与核孔复合物结合,以及蛋白通过核孔复合物的过程。随后,基于这两个步骤分别发现了与核蛋白核定位信号识别和结合的输入蛋白家族(Importin family)以及为转运提供能量的GTPase Ran过程。
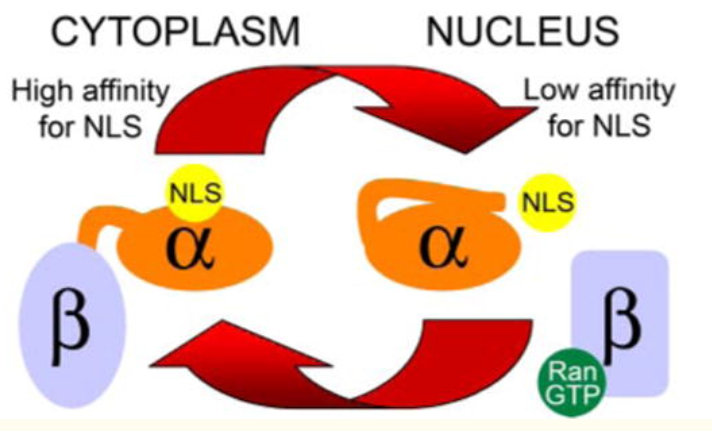
入核的分子机制
本文转载于:搜狗科学,baike.sogou.com/kexue/d19764456015799566.htm,本内容使用CC-BY-SA 3.0授权,用户转载请注明出处。