碳氢键极性强弱顺序:炔烃>烯烃>烷烃。主要是因为三键碳,双键碳和单键碳的碳原子轨道杂化类型不同导致吸电子能力不同,使酸性不同。
如何比较化学键的极性大小
比较极性大小如果有介电常数就比较介电常数如果没有数据就看键两端的原子以及原子所处的化学环境,相差越大,化学键的极性就越大。
化学键
化学键(chemical bond)是纯净物分子内或晶体内相邻两个或多个原子(或离子)间强烈的相互作用力的统称,使离子相结合或原子相结合的作用力通称为化学键。
分类
在一个水分子中2个氢原子和1个氧原子就是通过化学键结合成水分子。由于原子核带正电,电子带负电,所以我们可以说,所有的化学键都是由两个或多个原子核对电子同时吸引的结果所形成。化学键有3种类型 ,即离子键、共价键、金属键(氢键不是化学键)。
内容
离子键
带相反电荷离子之间的互相作用叫做离子键。共价键:共价键是原子间通过共用电子对(电子云重叠)而形成的相互作用。
金属键
化学键的一种,主要在金属中存在。由自由电子及排列成晶格状的金属离子之间的静电吸引力组合而成。定域键:只存在于两个原子之间的共价键。
极性键
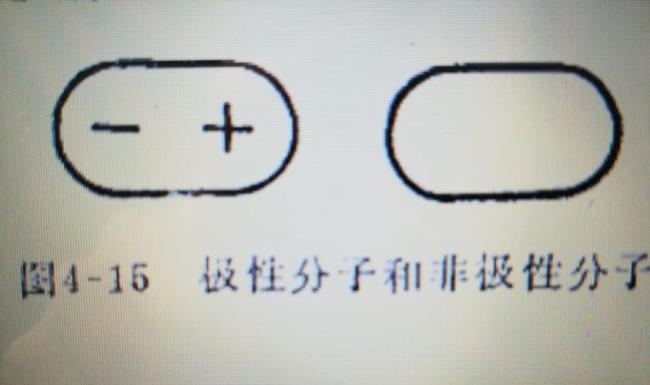
在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。这样的共价键叫做极性共价键,简称极性键。
非极性键
由同种元素的原子间形成的共价键,叫做非极性共价键。配位键:又称配位共价键,是一种特殊的共价键。