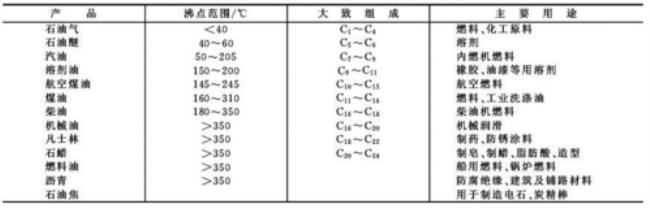
① 结构性质相似的物质,相对分子质量大,范德华力大,则熔、沸点也相应高。如烃的同系物、卤素单质、稀有气体等。
② 相对分子质量相同,化学式也相同的物质(同分异构体),一般烃中支链越多,熔沸点越低。烃的衍生物中醇的沸点高于醚羧酸沸点高于酯油脂中不饱和程度越大,则熔点越低。如:油酸甘油酯常温时为液体,而硬脂酸甘油酯呈固态。
上述情况的特殊性最主要的是相对分子质量小而沸点高的三种气态氢化物:NH3,H2O,HF比同族绝大多数气态氢化物的沸点高得多(主要因为有氢键)。
(4)某些物质熔沸点高、低的规律性
① 同周期主族(短周期)金属熔点。如
LiNaCl>NaBr>NaI。问题二:如何比较物质的沸点 1.由晶体结构来确定.首先分析物质所属的晶体类型,其次抓住决定同一类晶体熔、沸点高
低的决定因素.
① 一般规律:原子晶体>离子晶体>分子晶体 如:SiO2>NaCl>CO2(干冰)
② 同属原子晶体,一般键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高.