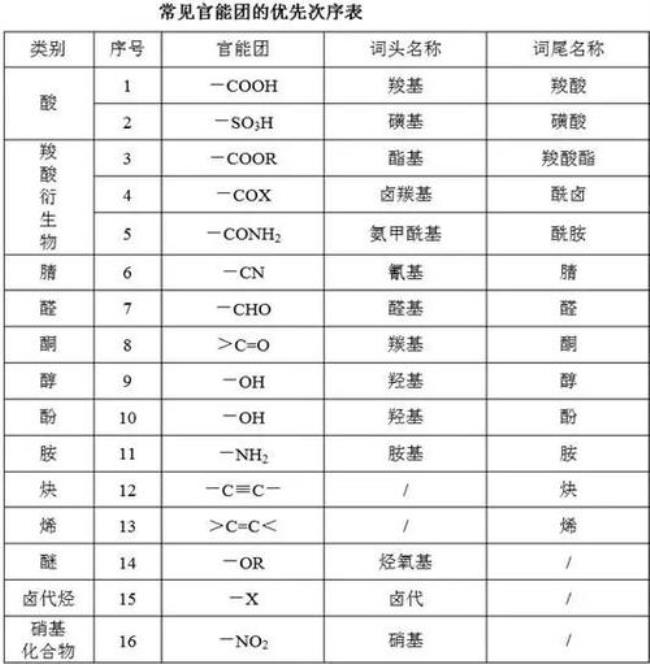
一般说来按照烷烃<烯烃<炔烃.
但是还有有无支链及支链多少的区别,而且对于烯烃和炔烃来说,还有对称与非对称的区别,有顺式与反式的区别,所以规律性不是十分明确.
如:
丁烷熔点-135℃.沸点-0.5℃1-丁烯结构简式CH3-CH2-CH=CH2.熔点为-185.4℃,沸点-6.4℃2-丁烯结构简式有顺式和反式两种异构体.顺式:熔点-139.3℃,沸点3.72℃1-丁炔 熔点-122.7℃ 沸点 8.1℃2-丁炔熔点 -32.3 沸点 27.0℃.
相同分子式的烃,其支链越多,溶沸点越低.对于结构式不同但具有相同分子式的烃,其对称性越强,溶沸点越高,分子间的作用力就越大,发生反应所需要的条件就越苛刻,所以说后者溶沸点大于前者.即1-丁烯的熔沸点低于2-丁烯.
沸点的根源比较的都是分子间的作用力,也就是传说中的范德瓦尔斯力,简单的可以想象成是两个分子的结构越利于它们吸在一起,力就越大分子量越大,力就越大电子云密度越集中,力就越大.