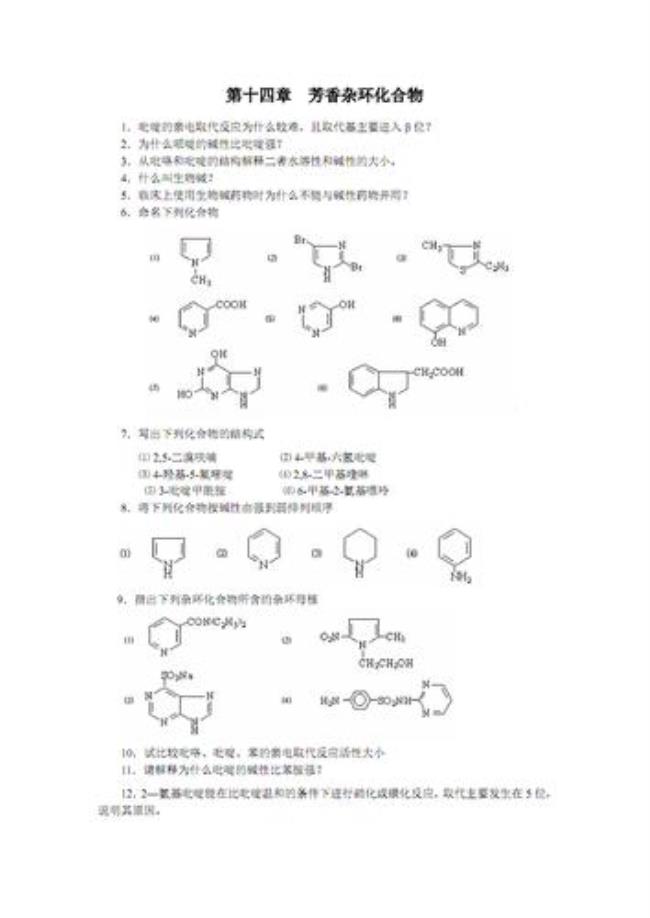
由大到小的顺序:吡咯>苯>吡啶。
原因:亲电取代反应的活性是由环上的电子云密度决定的,电子云密度越大,则亲电取代反应速率就越大,吡咯是五元环,但是π电子为6个,苯是六元环,其π电子也是6个,由此很容易看出吡咯环上的密度大于苯环(6/5 > 6/6),故吡咯的活性大于苯。
吡啶环也是六元环,其π电子也是6个,这点跟苯环是一样的(6/6 = 6/6),但吡啶环上有个杂原子N原子,N的吸电子能力大于C,故造成了吡啶环上的电子云密度比苯要小(一部分被N所吸),故吡啶的活性比苯差,吡啶中的N的作用就像是个硝基。